医美达健康管理有限公司是全国领先的医疗器械咨询服务机构,为1000余家以上的案例为企业提供专业的中国NMPA注册、生产/经营许可、欧盟CE MDR/IVDR/PPE、医疗器械单一审核程序(MDSAP)、FDA 510K、FDA CFR QSR820、ISO13485、GMP、临床CRO和临床评价服务。医美达(IMD)以专业、快速的全保姆式服务理念帮助企业快速获得医疗器械市场的通行证,提升行业竞争力,医美达(IMD)是行业最值得信赖的“医疗器械咨询服务机构”。

医疗器械CE标志(CE Marking)--制造商使用的一个标志,用来指明一个医疗器械符合法规要求加贴该标志的MDR和其它适用的欧盟协调法规中的适用要求,医美达(IMD)协助医疗器械产品打上CE标志后,意味着该产品可以在欧盟自由流动。
Read more >>
中国NMPA注册--医美达(IMD)全方位地为国内/国外医疗器械企业提供NMPA注册咨询服务,医疗器械获得相应的医疗器械资质后,该医疗器械能在中国合法地自由销售,按医疗器械注册人制度办理委托生产加工。
Read more >>
美国FDA注册--医美达(IMD)依托专业的精英团队,进行一系列的上市前SE评估(510K)、或者上市前批准(PMA)或者列名登记(Listing)后,该医疗器械能在美国合法任意地进行销售。
Read more >>
医疗器械单一审核程序(MDSAP)认证--共同利用管理资源管理有效、可持续的单一审核计划, 加强对医疗器械制造商的质量管理体系的监管,医美达(IMD)依托20多年的咨询师帮助企业符合美国FDA、奥大利亚(TGA)、巴西(ANVISA)、加拿大(CMDCAS)和日本(PMDA)医疗器械质量管理法规体系。
Read more >>
医疗器械风险分析服务---医美达(IMD)能全方位地协助企业按ISO14971/YY 0316要求建立风险管理团队、风险管理计划、风险分析、风险评估、风险控制、总体残留风险评估、风险管理审查、制作和后期制作活动等系列的风险管理活动。
Read more >>
医疗器械临床评价服务--医美达(IMD)汇聚了医疗器械行业的多年工作临床经验的专家团队,能确保企业符合国内外国家相关要求,满足临床评价各类需求。
Read more >>无论多么复杂的项目,我们都可以为您提供合身的定制方案,请留下您的联系方式,我们会在两个工作日内给你回电
15+

500+
6500+

1000+

FDA于7月底公布的UDI执行日期的最新指南:““唯一设备标识:关于I类和未器械的合规日期、直接标记和某些设备的全球唯一器械标识数据库要求的政策” (Unique Device Identificat
MORE>>“ 近期,很多客户咨询:欧盟法规医疗器械软件应该怎样认定?小编就此热点话题作集中解答,精炼总结出5大“金句”,帮助各位粉丝消化理解。”首先,它必须是一款软件!首先,该软件是用于处理输入数据、产生输出数
MORE>>随着新版9706实施日期的逼近,也有越来越多的小伙伴来咨询有关新版9706的问题,在此,小编与大家一同探讨下比较热门的5个问题,以下观点仅供参考。1.新版9706系列标准有哪些?实施日期分别是什么时候
MORE>>为贯彻落实我局《关于优化第二类医疗器械注册审评审批的若干措施》要求,进一步规范检验服务,根据《医疗器械监督管理条例》《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》等文件要求,有关医疗
MORE>>近期,英国MHRA更新了其医疗器械的监管要求,并发布了一份指南文件:“Guidance on registration of certain medical devices which are reu
MORE>>前言本次行业调研,围绕可重复使用内窥镜和一次性内窥镜两大内窥镜领域展开。可重复性使用内窥镜,发展历史已久、国产品牌诸多,但国内市场份额占比还有很大提升空间。目前国产替代进程如何、未来市场份额占比将如何
MORE>>MDD 93/42/EEC过渡到MDR 2017/745,医疗器械制造商面临的一个重大挑战是需要编制MDR 技术文档,证明产品安全性和有效性,并通过欧盟公告机构(NB)的MDR首次认证审核。尽早规划和修订MDR技术文档,将给医疗器械制造商带来诸多益处。 医疗器械指令MDD 93/42/EEC中,针对CE技术文档的内容并没有非常明确的要求,医疗器械制造商通常依赖公告机构的建议。欧盟医疗器械法规MDR 2017/745则在附录中,对技术文档的内容提出了具体的要求。其中,附录二列出了技术文档的六大章节,并要求技
MORE>>自国家药品监督管理局发布《医疗器械临床试验质量管理规范》及六个配套文件以来,对医疗器械临床试验的科学性、伦理性、真实性和规范性提出了较高要求。为帮助从事医疗器械临床试验相关工作的人员学习医疗器械临床试验相关政策法规,掌握医疗器械临床试验项目管理工作相关技能,中心拟于5月下旬在广州举办2021年第一期医疗器械临床试验质量管理规范(GCP)培训班
MORE>>为进一步明确管理者代表在质量管理体系中的职责,强化医疗器械生产企业质量主体责任意识,提升质量管理水平,根据《国家药品监督管理局关于发布医疗器械生产企业管理者代表管理指南的通告》(2018年第96号)、《广东省食品药品监督管理局关于医疗器械企业管理者代表的管理办法》(粤食药监法〔2010〕79号)要求,我中心定于5月中旬举办2021年度第一期医疗器械企业管理者代表资格培训班。
MORE>>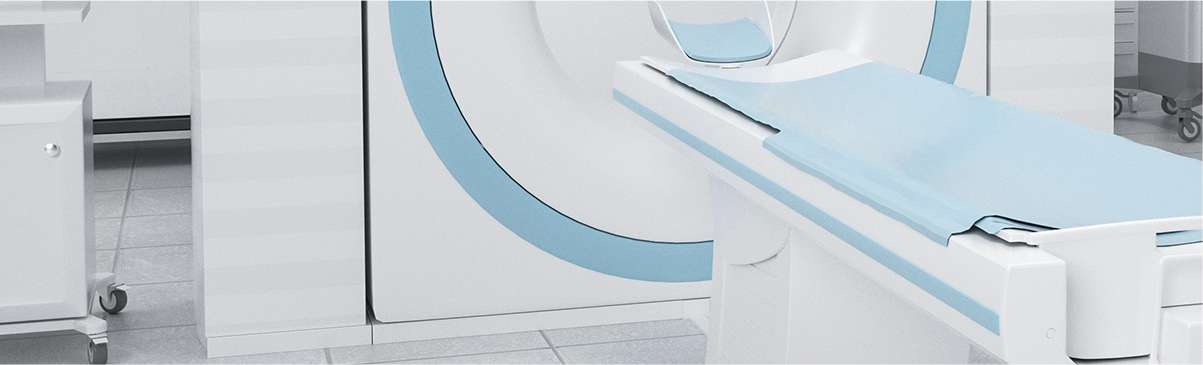 专注国内外各类医疗器械咨询服务
专注国内外各类医疗器械咨询服务

粤ICP备16048781号 Copyright 2016-2021 深圳医美达健康管理有限公司 All Rights Reserved
 广州电话:18613190779
广州电话:18613190779
 全国免费热线:400-608-3018
全国免费热线:400-608-3018
 东莞电话:18029158775
东莞电话:18029158775
 全国免费热线:400-608-3018
全国免费热线:400-608-3018
 深圳电话:18613190779
深圳电话:18613190779
 全国免费热线:400-608-3018
全国免费热线:400-608-3018
