医疗器械飞行检查服务
近年来,国际市场上频频发生医疗产品质量问题,这些事件暴露了一些国家医疗监管体制的缺失,也引发了各国对第三方评估市场准入机制的反思。PIP丑闻加速了此议案的实施进程,经过几年的酝酿与讨论,2013年9月25日欧盟在官方公报发布了2份重要文件(EU)No 920/2013和2013/473/EU,并宣布立即生效。2013/473/EU即为获证医疗器械CE产品飞行检查的要求。此法规从2014年起强制执行。
2013/473/EU指南赋予公告机构更大的权力,如允许他们对获证企业的生产场地进行突击检查,而不需要事先通知,对某些项目,审核时需要对生产现场产品进行抽样检查。无预先通知审核必须由两位审核员进行,并至少进行一天时间,除此之外,公告机构也可以对获证企业的重要供应商进行无预先通知审核。
在实际的飞行检查中,审核员可能:
检查近期生产或正在生产的产品的记录;
检查认证产品技术文件及欧盟医疗器械法规,标准的符合性;
对关键原材料,关键部件或整机的检查;
对CE技术文件,质量管理体系文件的评审;
现场抽取产品样品进行现场检验或由公告机构指定检测单位进行检验。
每次检查时,对以下适用的至少两个过程进行审核:
● 设计过程
● 采购或外包过程
● 装配过程
● 灭菌过程
● 包装过程
飞行检查的候选对象可能包括:
原始设备制造商(OEM);
参与医疗器械设计研发或医疗软件开发的供应商或分包商;
提供需要做确认的过程活动(灭菌,无菌包装,病毒灭菌等)的供应商或分包商;
提供不能完全通过来料检验和检测进行验证的关键原材料的供应商或分包商(如植入物的配件或原材料,动物组织材料)。
如果现场审核时,获证企业不能满足公告机构的标准时,有可能会对制造商进行警告或暂停CE证书的执行,从而影响到产品在欧盟市场的销售。飞行检查在维持证书上扮演着极其重要的角色。因此, 飞行检查的结果如果不好可能会导致证书被暂停,也不能再将产品销往欧盟,除非证书再次生效,关于不符合项的处理流程与现行常规审核一致。制造商不可以拒绝公告机构的飞检,否则审核组将在审核报告中记录并建议委员会暂停其资格。
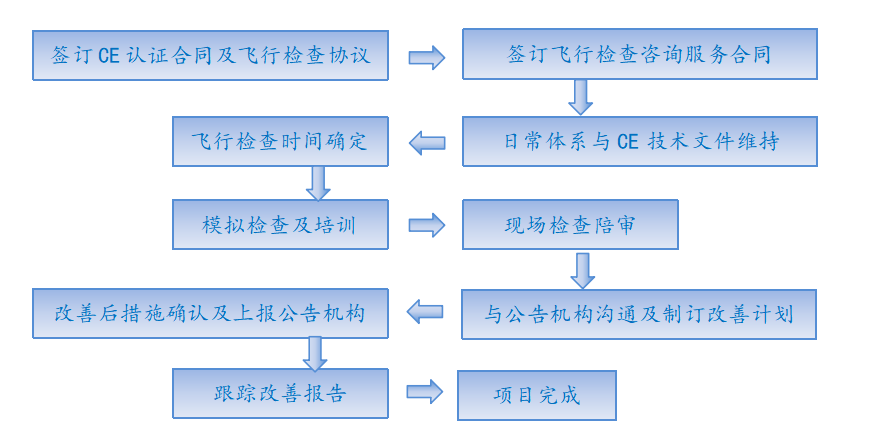
服务流程
选择医美达
中国、美国、欧洲本地医疗器械专家和法律法规专家为您服务
 中 国:18613190779
中 国:18613190779
 中 国:18029158775
中 国:18029158775
 邮 箱:33999439@qq.com
邮 箱:33999439@qq.com








