医美达健康管理有限公司是全国领先的医疗器械咨询服务机构,为1000余家以上的案例为企业提供专业的中国NMPA注册、生产/经营许可、欧盟CE MDR/IVDR/PPE、医疗器械单一审核程序(MDSAP)、FDA 510K、FDA CFR QSR820、ISO13485、GMP、临床CRO和临床评价服务。医美达(IMD)以专业、快速的全保姆式服务理念帮助企业快速获得医疗器械市场的通行证,提升行业竞争力,医美达(IMD)是行业最值得信赖的“医疗器械咨询服务机构”。

医疗器械CE标志(CE Marking)--制造商使用的一个标志,用来指明一个医疗器械符合法规要求加贴该标志的MDR和其它适用的欧盟协调法规中的适用要求,医美达(IMD)协助医疗器械产品打上CE标志后,意味着该产品可以在欧盟自由流动。
Read more >>
中国NMPA注册--医美达(IMD)全方位地为国内/国外医疗器械企业提供NMPA注册咨询服务,医疗器械获得相应的医疗器械资质后,该医疗器械能在中国合法地自由销售,按医疗器械注册人制度办理委托生产加工。
Read more >>
美国FDA注册--医美达(IMD)依托专业的精英团队,进行一系列的上市前SE评估(510K)、或者上市前批准(PMA)或者列名登记(Listing)后,该医疗器械能在美国合法任意地进行销售。
Read more >>
医疗器械单一审核程序(MDSAP)认证--共同利用管理资源管理有效、可持续的单一审核计划, 加强对医疗器械制造商的质量管理体系的监管,医美达(IMD)依托20多年的咨询师帮助企业符合美国FDA、奥大利亚(TGA)、巴西(ANVISA)、加拿大(CMDCAS)和日本(PMDA)医疗器械质量管理法规体系。
Read more >>
医疗器械风险分析服务---医美达(IMD)能全方位地协助企业按ISO14971/YY 0316要求建立风险管理团队、风险管理计划、风险分析、风险评估、风险控制、总体残留风险评估、风险管理审查、制作和后期制作活动等系列的风险管理活动。
Read more >>
医疗器械临床评价服务--医美达(IMD)汇聚了医疗器械行业的多年工作临床经验的专家团队,能确保企业符合国内外国家相关要求,满足临床评价各类需求。
Read more >>无论多么复杂的项目,我们都可以为您提供合身的定制方案,请留下您的联系方式,我们会在两个工作日内给你回电
15+

500+
6500+

1000+

ISO体系太多太乱,搞不清该做哪个?没关系!今天就来给大家挨个解读一下,哪些企业应该做什么样的体系认证最合适。不花冤枉钱,也别漏掉了需要的证书!ISO9001质量管理体系ISO9001标准是一个放之四
MORE>>日本医疗器械分类及监管方式日本将医疗器械按照风险等级分为以下类别:高度管理医疗器械(Ⅲ类、Ⅳ类)、管理医疗器械(Ⅱ类)、一般医疗器械(Ⅰ类)。根据2013年11月开始实施的《药事法》,日本医疗器械按照
MORE>>体外诊断医疗器械( IVDD),98/79/EC 是一项指令,而 IVDR 适用于所有经济运营商 (EO) 的立法(法规),即欧洲的制造商、进口商、用户、公告机构和国家当局经济区 (EEA) 和那些在
MORE>>01全国人大代表发声:支持国产高端医疗器械近日,据央广网消息,在今年的全国两会上,全国人大代表、国药集团国药控股股份有限公司党委书记、董事长于清明提交了《关于大力支持高端医疗器械制造业发展的建议》等建
MORE>>6629万!医疗器械经营企业被罚近日,北京市市场监督管理局公布了2022年“两品一械”领域“骄阳行动”成果。2022年,北京市市场监督管理局全年共查处“两品一械”领域违法案件2082件、罚没金额近1.
MORE>>近日,欧洲议会以压倒性多数投票(537票对3票、24票弃权)批准了欧盟委员会延长医疗器械法规(EU)2017/745(MDR)过渡期的提案,目的是为了给广大医疗器械制造商更多的时间来准备MDR的申请,
MORE>>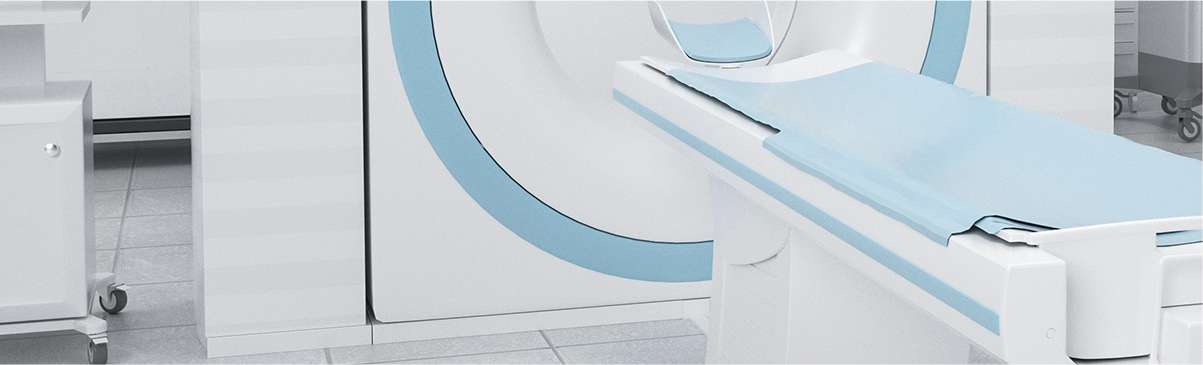 专注国内外各类医疗器械咨询服务
专注国内外各类医疗器械咨询服务

粤ICP备16048781号 Copyright 2016-2021 深圳医美达健康管理有限公司 All Rights Reserved
 广州电话:18613190779
广州电话:18613190779
 全国免费热线:400-608-3018
全国免费热线:400-608-3018
 东莞电话:18029158775
东莞电话:18029158775
 全国免费热线:400-608-3018
全国免费热线:400-608-3018
 深圳电话:18613190779
深圳电话:18613190779
 全国免费热线:400-608-3018
全国免费热线:400-608-3018
