拥抱变化-10条关于IVDR的应对之策
来源:医美达日期:2022-06-22阅读107
体外诊断医疗器械( IVDD),98/79/EC 是一项指令,而 IVDR 适用于所有经济运营商 (EO) 的立法(法规),即欧洲的制造商、进口商、用户、公告机构和国家当局经济区 (EEA) 和那些在欧洲市场放置或计划分销 IVD 的非欧盟制造商和供应商。
IVDR 由 113 篇文章(10 章)和 15 个附件组成,而 IVDD 则有 24 篇文章、10 个附件。毫无疑问,IVDR 监管冗长并且相当严格,但值得称赞的是,对监管变化和要求变得更加透明。
IVDR已于 2022 年 5 月 26 日开始实施,该过程中每个利益相关者都应对欧洲经济区 (EEA) 体外诊断市场负责。
■ 对于IVD生产商,应该做的第一件事是组织有关 EU IVDR 线上或线下的培训计划,以便使相关人员都知道必要的变化。
■ 之后应与所有供应商、分包商或服务提供商就流程及其义务进行正式沟通。
■ 执行差距评估以检查其资源的可用性,目前团队来更新 EU IVDR 要求的技术文档。获得 ISO 13485: 2016 认证将是建立合规性的额外优势。
■ 建议在过渡的早期就聘请主题专家或外部顾问,医美达咨询将提供专业服务。
■ 本文将提供详细的大纲和实用提示,以符合欧盟 IVDR 2017/746 下的各种文章和附件中所述的公告机构和主管当局的要求。

图1 IVDD和IVDR变化
1 为 IVDR 合规和商业变更做准备
对于医疗器械生产商而言,最重要的商业决策是确定他们是否希望继续将其 IVD 放置在欧洲经济区 (EEA)。如果答案是“是”,那么应该尽早从 NB 获得估算(成本)、时间表、审计范围、产品代码等。从指令到法规的转变需要强制性合规性和强大的技术文档,以建立安全性和有效性并获得 CE 认证。IVDR 在很大程度上依赖于临床证据,即科学有效性、分析性能和临床性能来确定安全性和有效性。
公告机构 (NB) 参与 CE 认证过程将是该法规的一个突出特点。这也表明对经济经营者的额外投资可能会间接增加产品成本。
根据 EU IVDR 2017/746 第 15 条现在任命“监管合规负责人 (PRRC)”是强制性的,负责人应确保 QMS 的符合性、符合性声明、技术文件、上市后监督和不良事件报告符合 EU IVDR。制造商应确保在其到期前完成整个过渡(包括新的认证申请)现有的 IVDD 证书或自我认证的符合性声明。公告机构自 2017 年 5 月 25 日起根据 IVDD 98/79/EC 颁发的证书应在 2024 年 5 月 27 日之后失效。
2 对分类有清晰的认识
重新考虑 IVDR 附件 VIII 下的新分类规则,并检查它是否影响了您之前的分类。
在准备 CE 认证过程之前,执行正确的分类至关重要。除非我们能够这样做,否则合规途径将不明确,并且会延迟或使我们为遵守 IVDR 要求所做的努力无效。
IVDR 是一种基于风险的方法,通过增加公告机构和主管当局控制来对设备进行分类。该法规确定了四个风险等级:A 级、B 级、C 级和 D 级,而附件 VIII 定义了七个分类规则以正确分类产品。IVDR 的一个独特之处在于,软件也归入附件 VIII 的实施规则 1.4,其中规定“驱动设备或影响设备使用的软件应与设备属于同一类。如果软件独立于任何其他设备,则应根据自身权利进行分类。这表明了受 IVDR 监管的软件的范围。制造商还必须相应地执行软件验证和确认(附件 II,6.4)。
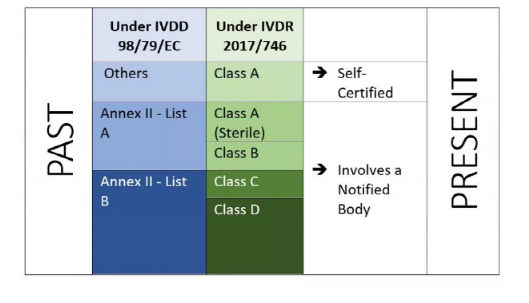
图2 IVDR 2017/746下基于风险的分类
3 公告机构的参与
公告机构 (NB) 的作用将是核心要素之一,因此与传统的“自我认证”方法相比,现在需要公告机构审核和认证大量制造商。经济运营商应谨慎决定合格评定途径(EU IVDR [3]附件 IX、X、XI )。
IVDR 不仅需要额外的投资,而且必须确保其技术文档和质量管理体系符合 IVDR 的新要求。在 IVDD 下,大多数 IVD 都是自我认证的 (92%),不需要指定机构的参与。而在新的 IVDR 下,情况就不一样了。
根据一项研究表明,近 85% 的 IVD 将需要公告机构的参与,只有 15% 的 IVD 有资格获得自我认证[5]。
这也意味着体外诊断 (IVD) 制造商现在将经历重大转变,以符合新的分类和认证流程。此外,根据设备的预期用途和风险等级,制造商需要确定一个指定的 NB,该 NB 可能能够对其进行审核并使其产品获得认证。最高风险的体外诊断(D 类)将需要欧盟参考实验室或专家小组来验证性能声明,此外还有公告机构 (NB) 或主管当局 (CA) 的参与。目前,根据欧盟 IVDR 指定的公告机构只有七家。
● 3EC International (Slovakia) – 2265
● BSI (Netherlands) – 2797
● DEKRA Certification (Germany) – 0124
● DEKRA Certification (Netherlands) – 0344
● GMED SAS (France) – 0459
● TÜV Rheinland LGA (Germany) 0197
● TÜV SÜD (Germany) – 0123
4 质量管理体系(QMS)的建立
IVD 制造商应在其经营场所内建立健全可靠的质量管理体系 (QMS)。根据 IVDR 第 10 条,这是制造商的一般义务。质量管理体系是其他各种要求中的一项基本要求,没有它,制造商将无法获得批准。
QMS 是为了确保制造、变更控制、客户投诉、资源管理、供应商和分包商的控制和验证、性能评估、质量测试、UDI 标签、上市后监督等都符合批准的 QMS 和上市后监督 (PMS ) 计划。
PRRC 必须确保制造商满足第 10 条“自我认证”(根据附件 IV 发布符合性声明)A 类 IVD 的要求,而在此过程中不需要公告机构 (NB)。
5 为供应链中断做好准备
在全球范围内,制造商在很大程度上依赖其供应链和原材料来生产和交付安全、准确和有效用于预期用途的 IVD。因此,当涉及到供应商和分包商的控制时,监管和质量问题也发展到更高的水平。因此,制造商应主动与供应链沟通其供应商和分包商的义务和责任。合法制造商应展示充分的供应商控制和监控,确保供应链符合 IVDR 的监管要求,重新考虑数据完整性和供应商数据质量的需求,实施稳健的供应商风险管理和绩效监控,并定期审核基于供应商的供应商对成品的相关风险。监管机构和公告机构强调合法制造商要清楚地记录供应商控制的水平,并用证据证明他们有可能降低供应商提供的产品或服务的风险。
6 确保审计和检查准备就绪
根据 IVDR 第 88 条“市场监督活动”,主管部门应对经济经营者以及供应商和/或分包商的场所以及在必要时在专业用户的设施进行通知(不通知)检查。制造商应在设计和制造信息的技术文档中包括有关识别所有地点的信息,包括供应商和分包商,其中制造活动是在其中进行的。执行 QMS 审核的公告机构 (NB) 应确定各个制造场所及其供应商和/或分包商之间的联系和责任分配。当 NB 特别想要审计这些供应商或分包商中的任何一个或两者兼而有之时,将考虑此信息。制造商供应商的场所,当被认为显着影响成品器械的符合性时,应基本上由 NB 审核(特别是当制造商无法证明对其供应商有足够的控制时)。
7 计划处理突击审核
在认证后监控下,NB 应继续对制造商及其分包商或供应商进行不事先通知的现场审核,以进行产品测试,并监控对制造商和与认证决定相关的任何条件的合规性,例如更新临床数据。定义的间隔。此外,公告机构应至少每五年对制造商现场以及制造商供应商和/或分包商的现场随机进行一次突击审核,这可能与定期监督评估相结合。
8 加强上市后监督活动
强烈建议制造商加强其上市后监管要求,并制定机制在欧盟成员国之间就警惕性和市场监管进行协调。根据适用于 C 类和 D 类器械的监督评估(附件 IX),指定机构应定期(至少每 12 个月一次)进行适当的审核和评估。它应包括在制造商和供应商和/或分包商的场所进行的审核(如适用)。制造商应基本上制定记录和报告事故和现场安全纠正措施 (FSCA) 的程序。
9 唯一设备标识符(UDI)和EUDAMED
制造商必须为 UDI 建立一个系统,以识别和促进设备的可追溯性。“设备标识符”和“生产标识符”应出现在标签上,以增强欧盟市场的可追溯性。可以参考经认可的发行实体 (IE) 列表,例如 GS1、HIBCC、ICCBBA、IFA GmbH 来操作系统UDI的分配。目前,上述 IE 自 2019 年 6 月 27日起生效,但明智的做法是在最终决定实施时确认其有效性。
欧洲医疗器械数据库 (EUDAMED) 将概述欧盟可用的所有医疗器械。它由以下六个模块组成:
◆自然人或法人注册,
◆唯一设备标识 (UDI) 和设备注册,
◆指定机构和证书,
◆临床调查和性能研究,
◆警戒系统和上市后监督,
◆市场监督。
为确保通过全面的 EUDAMED 提高透明度,部分经济运营商信息将公开访问。目前机密信息只能由欧盟成员国的经济运营商、赞助商、公告机构和主管当局访问。
10 “内部设备”的要求
卫生机构开发供同一卫生机构使用的“内部设备”(或“实验室开发的测试”)不得销售或出售给其他法人实体。这种设备可用于诊断和治疗,尤其是罕见病。该机构预计仅符合 IVDR 附件 I(一般安全和性能要求)的要求,并在 2024 年 5 月 26 日之前免除该规定的其余部分;前提是卫生机构满足条例第 5 条第 5 款规定的若干条件,并具有适当的质量管理体系,符合规定医学实验室质量和能力要求的国际标准 (EN ISO 15189) 或其他国家规定。







