医美达健康管理有限公司是全国领先的医疗器械咨询服务机构,为1000余家以上的案例为企业提供专业的中国NMPA注册、生产/经营许可、欧盟CE MDR/IVDR/PPE、医疗器械单一审核程序(MDSAP)、FDA 510K、FDA CFR QSR820、ISO13485、GMP、临床CRO和临床评价服务。医美达(IMD)以专业、快速的全保姆式服务理念帮助企业快速获得医疗器械市场的通行证,提升行业竞争力,医美达(IMD)是行业最值得信赖的“医疗器械咨询服务机构”。

医疗器械CE标志(CE Marking)--制造商使用的一个标志,用来指明一个医疗器械符合法规要求加贴该标志的MDR和其它适用的欧盟协调法规中的适用要求,医美达(IMD)协助医疗器械产品打上CE标志后,意味着该产品可以在欧盟自由流动。
Read more >>
中国NMPA注册--医美达(IMD)全方位地为国内/国外医疗器械企业提供NMPA注册咨询服务,医疗器械获得相应的医疗器械资质后,该医疗器械能在中国合法地自由销售,按医疗器械注册人制度办理委托生产加工。
Read more >>
美国FDA注册--医美达(IMD)依托专业的精英团队,进行一系列的上市前SE评估(510K)、或者上市前批准(PMA)或者列名登记(Listing)后,该医疗器械能在美国合法任意地进行销售。
Read more >>
医疗器械单一审核程序(MDSAP)认证--共同利用管理资源管理有效、可持续的单一审核计划, 加强对医疗器械制造商的质量管理体系的监管,医美达(IMD)依托20多年的咨询师帮助企业符合美国FDA、奥大利亚(TGA)、巴西(ANVISA)、加拿大(CMDCAS)和日本(PMDA)医疗器械质量管理法规体系。
Read more >>
医疗器械风险分析服务---医美达(IMD)能全方位地协助企业按ISO14971/YY 0316要求建立风险管理团队、风险管理计划、风险分析、风险评估、风险控制、总体残留风险评估、风险管理审查、制作和后期制作活动等系列的风险管理活动。
Read more >>
医疗器械临床评价服务--医美达(IMD)汇聚了医疗器械行业的多年工作临床经验的专家团队,能确保企业符合国内外国家相关要求,满足临床评价各类需求。
Read more >>无论多么复杂的项目,我们都可以为您提供合身的定制方案,请留下您的联系方式,我们会在两个工作日内给你回电
15+

500+
6500+

1000+

近日,北京市药监局官网对“医疗器械注册证变更后,旧版本包材有无使用宽限期”这一问题进行了权威答复。问:医疗器械注册证变更文件批准下发之后,变更前版本的包材有余量,能否继续使用?有无使用宽限期?答:根据
MORE>>医疗器械生物学评价是医疗器械风险管理的一个重要组成部分,在对新器械进行评价时,如果器械不与组织直接或间接接触,申请人应明确声明,且无需提供进一步的生物相容性信息。而对与人体直接或间接接触的医疗器械进行
MORE>>在医疗器械注册过程中,注册申报资料的编写提交是极为重要的一环,根据《医疗器械注册申报资料要求及说明》,第二部分综述资料中有一项“产品描述”,那么产品描述具体应包括哪些内容呢?今天我们就来跟大家分享一下
MORE>>为进一步指导注册申请人确定具体产品的临床评价路径,器审中心按照《医疗器械监督管理条例》的有关规定,根据《决策是否开展医疗器械临床试验技术指导原则》等规范要求,基于目前的审评经验以及《医疗器械分类目录》
MORE>>本次汇总的2020年7月-2021年12月医疗器械产品分类界定结果共1077个,其中建议按照Ⅲ类医疗器械管理的产品155个,建议按照Ⅱ类医疗器械管理的产品505个,建议按照I类医疗器械管理的产品143
MORE>>本次汇总的2020年7月-2021年12月医疗器械产品分类界定结果共1077个,其中建议按照Ⅲ类医疗器械管理的产品155个,建议按照Ⅱ类医疗器械管理的产品505个,建议按照I类医疗器械管理的产品143
MORE>>11月21日,江西省药监局官网发布《关于对医疗器械注册人制度下委托生产第二类医疗器械注册提供前置咨询服务的通知》,具体事项如下:一、前置咨询服务对象前置咨询服务对象为医疗器械注册人制度下拟通过委托生产
MORE>>11月20日,江苏省药监局发布《关于提供第二类医疗器械技术审评补正资料预审查服务的通告(2023年 第9号)》。具体内容摘录如下:一、第二类医疗器械技术审评补正资料预审查服务是指医疗器械注册申请人按补
MORE>>为进一步完善药品医疗器械经营许可告知承诺制,深圳市市场监管局于11月20日通过其官网发布《深圳市市场监督管理局关于暂停实施部分药品医疗器械经营许可告知承诺制事项的通知》。通知显示,自该通知下发之日起暂
MORE>>随着人们对于医疗水平的要求和生物医学工程领域科学技术的不断提高,在传统用于充当物理屏障,保持伤口愈合环境清洁的敷料类产品基础上,敷料类产品正逐渐向材料创新、功能多元和形式多样的方向发展。从我国最早于2
MORE>>广东省医疗器械质量监督检验所(以下简称“省医械所”)对多个医疗器械送检问题作出解答,涵盖检验费用、送检资料获取途径等送检常见疑问,具体内容如下:Q1 注册检验是否免费?变更注册、延续注册以及注册补检呢
MORE>>众所周知,办理《医疗器械生产许可证》时需提交不少资料,那么提交这些资料时都有哪些注意事项呢?本文汇总了北京市药监局发布的有关《医疗器械生产许可证》资料提交的相关注意事项,具体如下:01 Q:许可事项办
MORE>>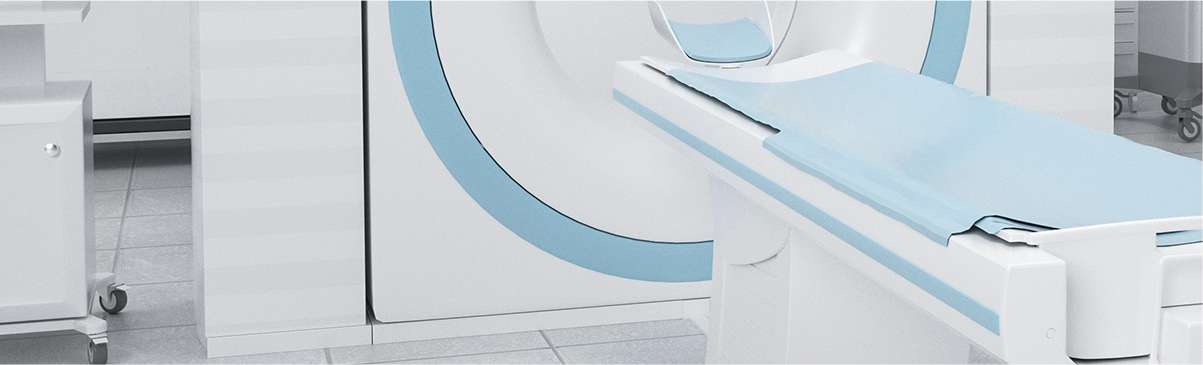 专注国内外各类医疗器械咨询服务
专注国内外各类医疗器械咨询服务

粤ICP备16048781号 Copyright 2016-2021 深圳医美达健康管理有限公司 All Rights Reserved
 广州电话:18613190779
广州电话:18613190779
 全国免费热线:400-608-3018
全国免费热线:400-608-3018
 东莞电话:18029158775
东莞电话:18029158775
 全国免费热线:400-608-3018
全国免费热线:400-608-3018
 深圳电话:18613190779
深圳电话:18613190779
 全国免费热线:400-608-3018
全国免费热线:400-608-3018
