FDA最新要求:12月8日起,Ⅰ类和未分类器械要强制执行UDI啦!
来源:医美达日期:2022-11-18阅读235
今年7月,FDA发布最新UDI指南《医疗器械唯一标识:关于Ⅰ类和未分类器械的合规日期、直接标记和特定器械的全球唯一器械标识数据库要求的政策》。
根据该文件,Ⅰ类和未分类器械将从2022年12月8日起开始执行UDI,具体要求如下:1)所有医疗器械产品向FDA GUDID注册产品数据;2)产品包装具备UDI载体。
事实上,美国自2007年以来就开始了UDI数据库的建立,自2014年9月24日首次明确要求Ⅲ类医疗器械的标签和包装需具备UDI码且需提交至GUDID数据库,而自2016年9月24日开始,进一步要求进入美国市场的第二类器械(占美国医疗器械总量的60%-70%)包装和标签必须具有UDI码。如今,UDI的执行对象囊括了所有Ⅰ类和未分类器械,足见美国对UDI推行的重视程度、对产品追溯的坚定决心。
相信大家应该都有所了解,UDI是唯一器械标识(Unique Device Identification)的缩写,由DI和PI 两部分组成。DI通常包括:包装指示符、厂商识别代码、商品项目代码、校验码;PI 则根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等。DI和PI组成了一个完整的UDI标识,按FDA的要求,产品出口时需将UDI信息上传至GUDID数据库,并打印出来加贴在产品和包装盒上。
值得注意的是,企业申请美国GUDID数据库账户权限时,必须拥有邓白氏码(D-U-N-S Number)。以下为UDI申请流程图☟
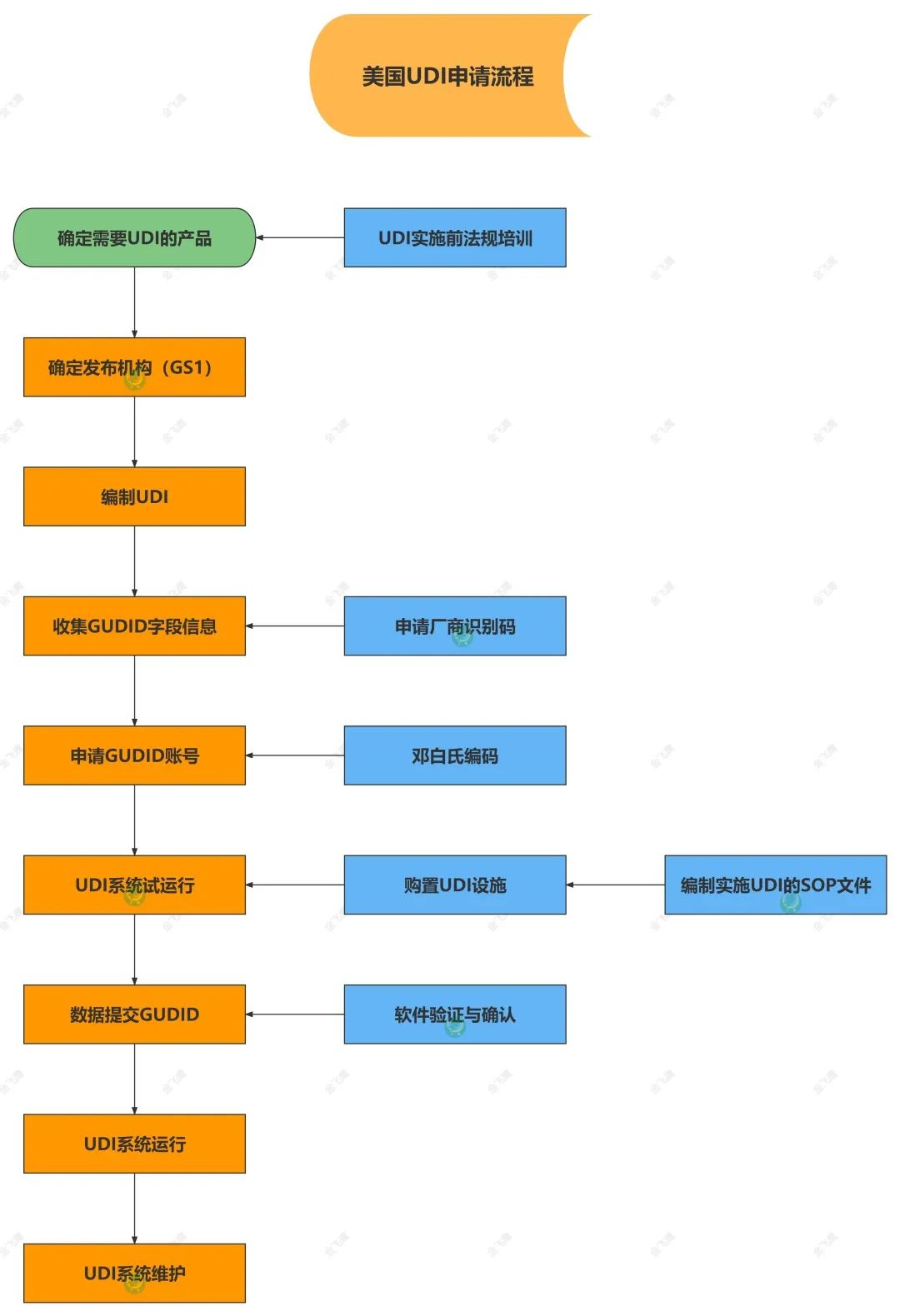
距12月8日仅剩不到一个月,假如您的产品有出口美国的需求,欢迎联系我们!在美国UDI申请方面,我们能为您提供的服务有:
●UDI申请流程及法规要求培训
●UDI申请
●邓白氏码申请
●UDI试运行
●UDI数据提交
●UDI系统维护服务
●医美达UDI追溯管理软件







