监管升级!FDA将有权销毁未完成注册的假冒器械!
来源:医美达日期:2022-11-16阅读192
据世界卫生组织(WHO)统计,全球市场上超过10%的医疗器械是伪造品。这些有问题的产品可能是由低劣部件组装而成的,更糟的是,这些假冒零部件可能含有有毒物质。
无论在哪种情况下危险性是相同的。无论对患者和医疗服务提供者,可能造成人身伤害、永久残疾、甚至死亡,生产商对假冒医疗器械负有很大的责任。
过去几年里,FDA报告了大量假冒的医疗产品,如未消毒的手术绷带,不标准的血糖试纸及假药等,2021年美国海关查获上亿美元的假冒医疗产品,包括医疗器械,药品,个人护理用品,电子元件及电力系统等。
而就在近期,FDA在其官网发布公告,明确了“假冒设备”的定义:
未经授权而带有商标、商号或其他识别标记或印记、或使用任何与其他已注册产品有相似之处的设备或其容器、包装或标签;
使用设备制造商、加工商、包装商或经销商的设计制造的设备,并在设备销售的过程中错误地声称为该设备制造商、加工商、包装商或分销商的产品;
由其他设备制造商、加工商、包装商或分销商包装或分销的设备。
此外,FDA在本次声明中也提出了将拒绝疑似假冒器械的入境,并授予了FDA新的权力来销毁某些被拒绝进入的器械。
医疗行业具有独特的品牌安全的竞争模式,2021年,FDA共通报拒绝进口医疗产品6733批次,中国产品被FDA拒绝进口的医疗产品共1562批次(医药品294批次、医疗器械1268批次),其中因涉及企业未注册问题而被拒绝进口的有59.3%,因涉及标签问题而被拒绝进口的有58.8%,因产品与已上市合法产品为非实质性等同或未申请510(k)而被拒绝进口的有33.7%,这些产品在FDA的最新标准中都将被认定为假冒设备,除了出口产品可能会被FDA销毁外,企业声誉也将受到损失,会给后续的国际市场开发带来巨大的负面影响!
中国医疗器械制造商在走向国际市场的过程中需要认识到,如何“合规”地“走出去”更加重要!
FDA注册信息必须每年在10月1日至12月31日之间重新提交(即年度更新),即使没有发生任何变化。产品登记信息也必须每年在10月1日至12月31日之间进行重新审核。
财政年度2022至2023的年度注册用户费用详情如下:
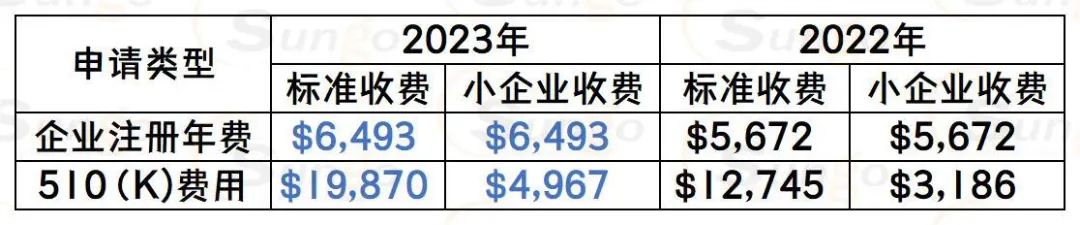
目前距离2023年年度注册的截止日期还有不足两个月,我们提醒所有客户尽快完成FDA年度注册,同时寻找有经验的美国代理人开展紧密合作,以确保注册有效和出口贸易顺利。







