医疗器械产品留样及送样比例有何要求?
来源:医美达日期:2022-04-01阅读956
医疗器械产品留样比例或数量有何要求?
生产企业应当根据留样目的、检测项目以及留样样品的不同,明确具体留样样品的留样比例或数量。留样量一般与留样目的、留样样品、检测项目相适应。留样比例或数量原则上由生产企业自行确定,但应当满足以下要求:
(1)至少能支持一次质量可追溯检测;
(2)对于无菌产品,每个生产批或灭菌批均应当留样;
(3)对于因新产品、新工艺或变更产品有效期等指标留样的,应当单独计算留样量,不得影响质量追溯检测。
如何制定环氧乙烷残留限量的指标?
注册申请人可以依据申报产品的相关标准对环氧乙烷残留限量指标进行制定;若无相关标准供参考,可根据GB/T16886.7要求以及产品实际使用情况进行制定,并提供相关支持性资料。
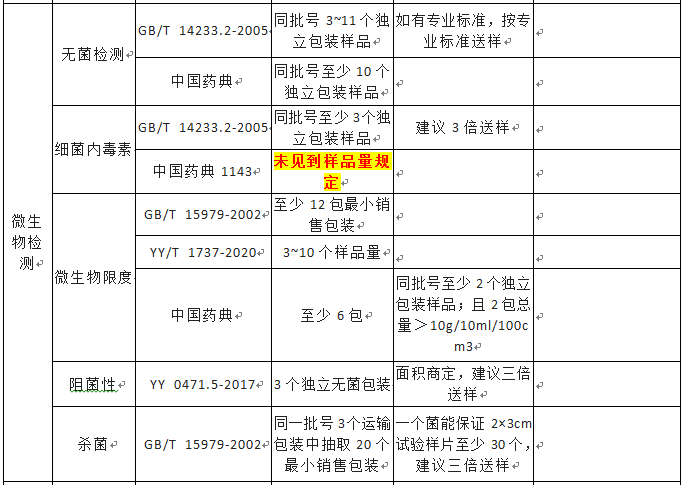
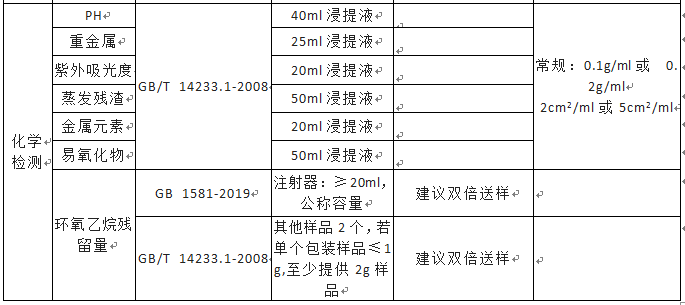
无源医疗器械检测送样量及说明