资讯:欧盟发布泌尿妇外科网状植入物警戒系统指南(含报告示例)
来源:医美达日期:2024-06-12阅读52
欧洲当地时间2024年6月11日,MDCG 2024-1-5指南发布,该指南是针对用于盆腔器官脱垂修复和压力性尿失禁的泌尿妇外科网状植入物的警戒系统指南文件,概述了报告事故和严重事故的方法。
指南内容概要:
1、应该报告什么
(1)个别严重事件
根据MDR第87条的规定,制造商应当向有关主管当局报告严重事故,其中,严重事故的定义可参见MDR第2(65)条。
向相关主管当局的报告应在MDR第87(2)至(5)条中规定的时间范围内。
(2)定期总结报告
根据MDR第92(8)(a)条所述,制造商与负责协调定期总结报告的各自国家主管当局达成协议时,可以以统一的方式报告使用相同器械或器械类型的类似严重事件。
如,当发生涉及同一特定器械或器械类型的类似严重事故,且已查明根本原因或已实施现场安全纠正措施时,或当严重事故是常见的且有据可查时,可以提交定期总结报告。
定期总结报告的格式、内容和频率应与主管当局商定。
(3)趋势报告
趋势报告的要求可参见MDR第88条。
2、报告示例
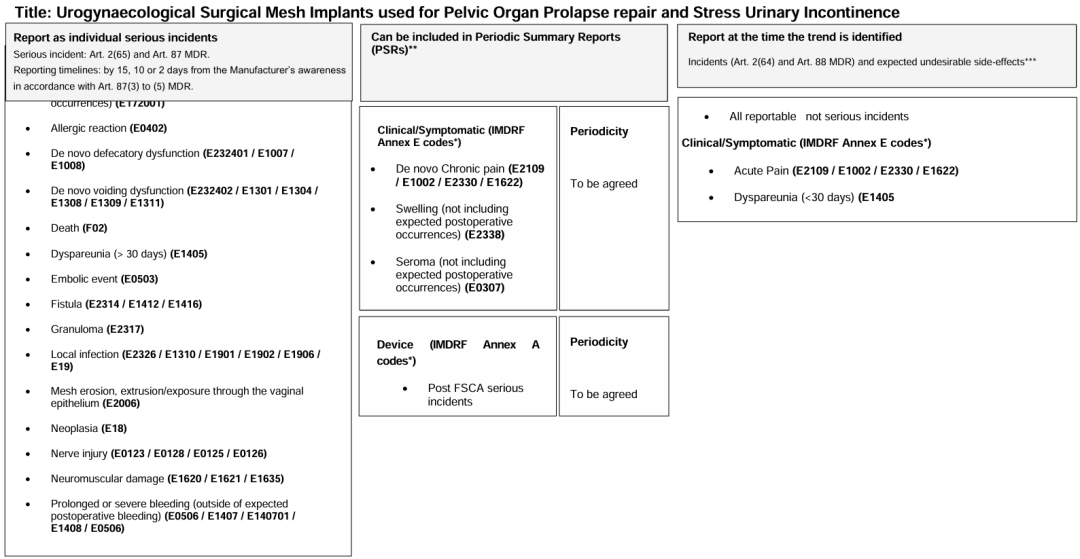
指南中列举了一份示例表格,其详细介绍了用于骨盆器官脱垂修复和压力性尿失禁的泌尿妇外科网状植入物,应该报告哪些由于器械的原因导致的或促成的事件或严重事件。下图可供参考,详细信息可见指南第3点内容。
3、临床参考文献和临床指南
制造商可以使用临床参考文献或目前的临床指南,也可参考相关的当地临床指南,以便识别事件。
4、IMDRF不良事件分类报告术语
制造商应查阅最新版本的IMDRF不良事件规范,以下是查询链接:
https://www.imdrf.org/documents/terminologies-categorized-adverse-event-reporting-aer-terms-terminology-and-codes
指南原文链接:
https://health.ec.europa.eu/document/download/c8441ddc-c586-4dbf-afc8-6ec3250df54b_en?filename=mdcg_2024-1-5_en_0.pdf







