热点速报∣新冠病毒抗原检测千亿市场即将开启!
来源:医美达日期:2022-03-17阅读350
国外疫情高发,香港疫情大爆发,内地本土疫情多点散发,涉及山东、吉林、江苏等17个省市。为了进一步提高“早发现”能力,近日,国务院应对新型冠状病毒肺炎疫情联防联控机制综合组印发了《新冠病毒抗原检测应用方案(试行)》,明确“社区居民有自我检测需求的,可通过零售药店、网络销售平台等渠道,自行购买抗原检测试剂进行自测”的要求。
新冠抗原检测即将开启
3月10日,国务院应对新型冠状病毒肺炎疫情联防联控机制综合组发布《关于印发新冠病毒抗原检测应用方案(试行)的通知》,并发布《新冠病毒抗原检测应用方案(试行)政策解读》。
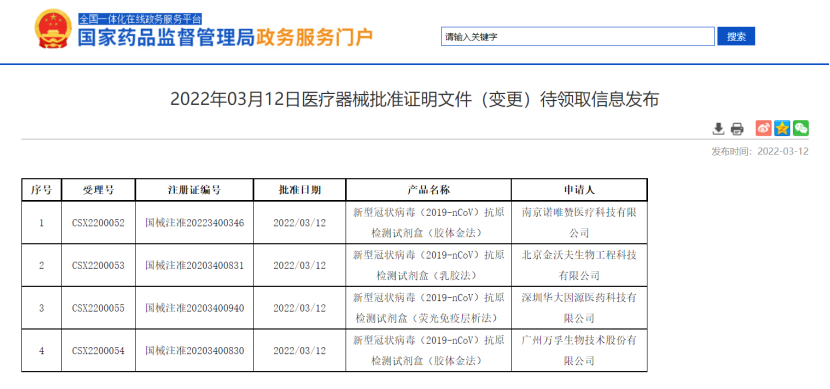
3月12日,国家药监局发布《关于做好新冠病毒抗原检测试剂质量安全监管工作的通知》,指出各级药品监督管理部门要加强注册相关管理工作、加强生产环节监督检查、加强经营环节监督检查和严厉打击违法违规行为。根据国家药监局网站信息,北京华科泰生物技术股份有限公司、南京诺唯赞医疗科技有限公司、北京金沃夫生物工程科技有限公司、深圳华大因源医药科技有限公司和广州万孚生物技术股份有限公司五家企业的5款新型冠状病毒抗原检测试剂盒获得医疗器械批准证明文件(变更),根据业内观点,此次公布的变更待领取信息极有可能为允许居民自测。自此,如果五款新冠抗原自测产品正式上市,国内新冠居家检测广阔市场即将正式开启。

《新冠病毒抗原检测应用方案(试行)》分别从抗原检测适用人群、基层医疗卫生机构抗原检测应用、隔离观察人员抗原检测应用、社区居民抗原检测应用、核酸检测的确认、人员培训和宣传教育六个方面对抗原检测应用方案进行详细说明。抗原检测作为补充手段可以用于特定人群的筛查,有利于提高“早发现”能力。
国际市场应用广泛
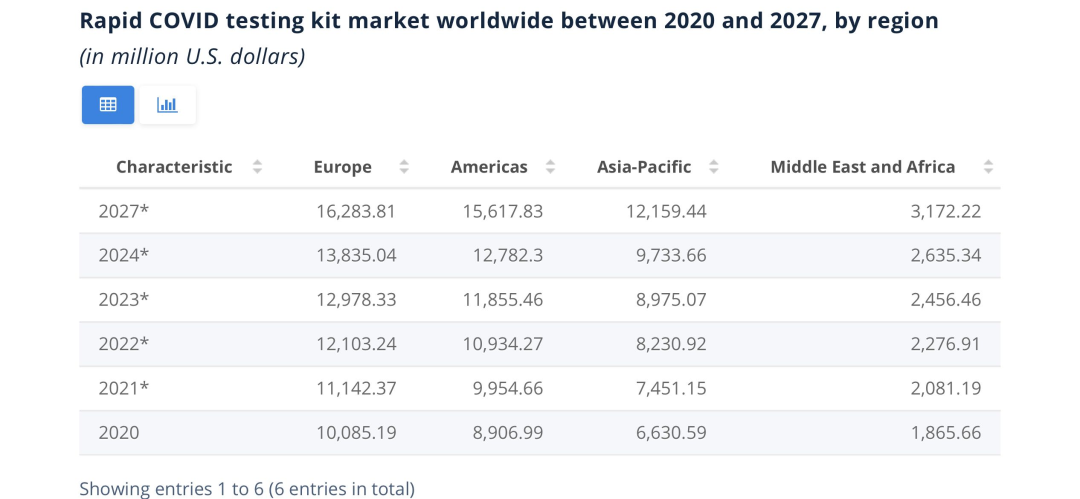
新冠病毒快速测试产品市场规模预测
从国际市场看,新冠抗原检测因其快捷和方便,在美国、欧洲、东南亚、澳大利亚等国家和地区应用广泛。从2020年11月开始,美国FDA陆续批准多款可居家进行的新冠分子诊断试剂盒,在美国疫情蔓延的大背景下,新冠抗原检测试剂盒因其可操作性强、价格低廉、检测效率高等特点,是核酸检测的有效补充,产品在市场迅速铺开。同时,随着新冠疫情不断反复,新冠抗原检测试剂盒在美洲、欧盟、亚太地区、澳洲等地区市场具有重要地位。
新冠检测市场未来发展趋势
在我国,除了香港、台湾等地区开展了大规模新冠抗原实践之外,其他地区均未开始。在香港地区抗击疫情过程中,新冠抗原检测试剂作为新冠核酸检测的有效配合手段,在新冠病毒检测中起到了相当的作用。根据信息显示,截至3月9日香港特别行政区政府卫生署卫生防护中心列表10款符合特区政府行政管理要求的新冠抗原测试产品,同时提供了国家药监局、欧盟及美国食品及药物管理局等监管机构的快速抗原测试产品的名单供市民选购参考。
随着《关于印发新冠病毒抗原检测应用方案(试行)的通知》印发,国内新冠抗原检测市场的大幕即将拉开,中泰证券在研报中指出,参考海外发放和购买政策,随着国内新冠抗原检测设备市场放开,使用群体将包括疫情防控机构、社区医疗服务机构、公立医院、个人等,预计国内新冠抗原自检试剂盒年市场规模将超过千亿元。同时,根据核酸检测试剂产品的经验,多家上市生物基因企业因核酸检测试剂产品市场盈利超亿元甚至几十亿规模。但由于抗原检测的成本受生产规模、原料来源等因素的影响较大,目前生产成本上涨幅度大,关键原材料需求旺盛,下一步市场规模和市场定价还需根据监管机构、渠道和市场等几方共同作用才能确定。







