FDA发布邮件强制要求UDI,制造商应尽早办理!
来源:医美达日期:2023-06-19阅读94
最近,美国食品和药物管理局(FDA)向医疗器械注册人发送有关唯一器械标识(UDI)合规性和上市要求的电子邮件。
这些信件特别提到了加载到该机构的全球唯一设备识别数据库(GUDID)中的设备清单和UDI信息的明显差异。
在这些信件中,FDA指出相关责任方按照21 CFR 801.20, 21 CFR 801.45 和21 CFR 801.50 的要求在医疗器械上加贴UDI,并按照21 CFR 830.300 的要求将UDI上传至GUDID数据库。
标签上和GUDID中UDI的要求合规日期是在2022年年底前。
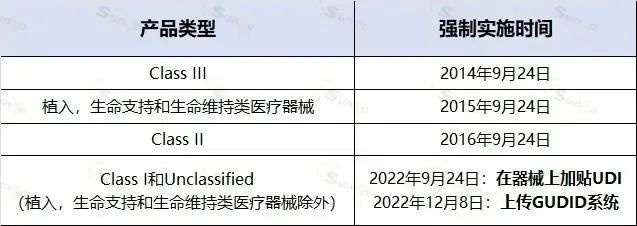
美国udi强制实施时间表
此外,应该注意在许多情况下,供应链中的多个公司必须向FDA注册他们的机构并列出他们的设备。例如,规范开发人员、合同制造商和投诉文件维护机构都需要注册和列出设备。但是这些设备只需要一个UDI和GUDID条目。
FDA提到,希望标签商在法规规定的时间内完成更新,即在2023年7月底之前完成,以确保在AccessGUDID和openFDA上发布该领域时公开发布准确的信息。
那么,如果制造商收到FDA的问询邮件,应该怎么做呢?
1、检查您的设备是否符合各种豁免UDI要求;
2、确定是否与供应链中的另一家公司达成协议,由他们处理FDA关于UDI和GUDID需求;
3、确定您的所有器械是否在FDA GUDID数据库中列出,并在FDA器械列表数据库中适当列出。
如果贵公司的所有器械都符合这些条件中的任何一个,请联系FDA解释情况,以及为什么与GUDID注册无关,以便机构知道您已经审查了信息并且没有违规。

如果邮件中提到的问题是确实存在的,您将需要尽快更新您的设备列表和/或您的GUDID帐户,以确保产品能够在美国市场能够继续合规的流通。
UDI正在成为各国监管部门加强医疗器械可追溯性管理的标配,将逐渐成为全球化的趋势。
对于企业而言能在同类竞品前更加完善出口目的国的法规要求,将在未来贸易战中凸显不可忽视的优势,企业应尽早办理。
如果您有任何疑问,可以扫下方二维码或登录官网http://www.imd-cfda.com/ 联系我们!我们的业务范围包括但不限于:国内外医疗器械(包含有源、无源、植入、无菌、义齿、IVD、软件)注册、进口医疗器械注册、许可备案、体系辅导、企业培训、软件开发等,国内外医疗器械注册全产业链一站式服务,请认准医美达。







